Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
Bảng tuần hoàn các nguyên tố hoá học
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 07:34
- Viết bởi Nguyễn Văn Đàm
Trong nghiên cứu, giảng dạy và học tập hoá học thì bảng tuần hoàn (hay hệ thống tuần hoàn) các nguyên tố hoá học là một công cụ rất cần thiết. Có nhiều dạng bảng tuần hoàn khác nhau như bảng tuần hoàn dạng bậc thang, bảng tuần hoàn dạng quạt xoè, bảng tuần hoàn dạng múi nhưng phổ biến nhất là bảng tuần hoàn dạng ô (có hai loại bảng dài và bảng ngắn). Ở bài này chúng ta nghiên cứu bảng tuần hoàn dạng ô dài.

1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố trong BTH được xếp theo chiều tăng dần của điện tích hạt nhân (từ trái sang phải, từ trên xuống dưới)
- Các nguyên tố có cùng số lớp e xếp vào cùng một hàng (chu kì).
- Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).
Bài toán tìm nguyên tố
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 07:37
- Viết bởi Nguyễn Văn Đàm
Bài toán tìm nguyên tố là một bài toán khá phổ biến trong hóa học. Với mỗi nguyên tố có hai đại lượng đặc trưng là:
- Số hiệu nguyên tử của nguyên tố (Z).
- Nguyên tử khối trung bình của nguyên tố (M).
Bài viết này đề cập đến cách tìm nguyên tố dựa vào nguyên tử khối trung bình của nguyên tố. Theo cách này, có thể gặp các dạng bài tìm nguyên tố như sau:
Mối quan hệ giữa các nguyên tố trong bảng tuần hoàn
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 07:40
- Viết bởi Nguyễn Văn Đàm
Vị trí của các nguyên tố trong bảng tuần hoàn có mối quan hệ với nhau.

Cụ thể là:
- Nếu 2 nguyên tố A và B ở cùng 1 chu kì và ở 2 nhóm A liên tiếp thì:
|ZA - ZB| = 1 nếu nguyên tố thuộc chu kì nhỏ
|ZA - ZB| = 11 nếu nguyên tố thuộc chu kì lớn và ở nhóm IIA và IIIA
- Nếu 2 nguyên tố thuộc cùng một nhóm A và ở 2 chu kì liên tiếp thì:
So sánh tính chất của các nguyên tố trong bảng tuần hoàn
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 07:46
- Viết bởi Nguyễn Văn Đàm
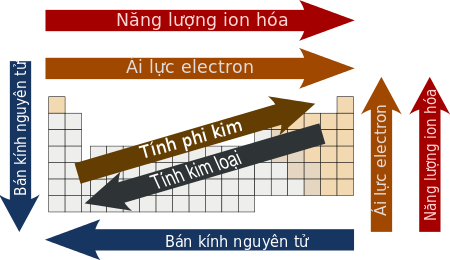
Theo định luật tuần hoàn thì tính chất của các đơn chất cũng như thành phần và tính chất của các hợp chất tạo bởi chúng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân. Như vậy nhiều tính chất của các nguyên tố trong bảng tuần hoàn biến đổi có quy luật theo chu kì và theo nhóm. Dựa vào vị trí tương đối của các nguyên tố trong bảng tuần hoàn, chúng ta có thể so sánh được tính chất của các nguyên tố đó và hợp chất của chúng. Dưới đây là bảng tóm tắt sự biến đổi tuần hoàn của một số tính chất thường gặp theo chu kì và nhóm A:
Mối quan hệ giữa cấu hình e nguyên tử và tính chất của nguyên tố
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ ba, 07 Tháng 7 2015 09:51
- Viết bởi Nguyễn Văn Đàm
Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được một số tính chất đặc trưng của nguyên tố đó. Cụ thể là:
1. Loại nguyên tố
- Nguyên tử có 1, 2, 3 e ở lớp ngoài cùng: là nguyên tố kim loại (trừ H, He).
- Nguyên tử có 5, 6, 7 e ở lớp ngoài cùng: thường là nguyên tố phi kim.
- Nguyên tử có 8e ở lớp ngoài cùng: là nguyên tố khí hiếm (cả trường hợp He có 2e).
- Nguyên tử có 4e ở lớp ngoài cùng là phi kim nếu thuộc chu kì 2, 3 và là kim loại nếu thuộc các chu kì khác.
Mối quan hệ giữa cấu hình e với vị trí của nguyên tố
- Chi tiết
- Chuyên mục: Chương 2. Bảng tuần hoàn các nguyên tố hóa học & định luật tuần hoàn
- Được viết ngày Thứ ba, 07 Tháng 7 2015 09:56
- Viết bởi Nguyễn Văn Đàm
Giữa cấu hình electron nguyên tử và vị trí của nguyên tố trong bảng tuần hoàn có mối quan hệ qua lại với nhau. Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn và ngược lại. Cụ thể như sau:
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
- Số thứ tự chu kì = số lớp e.
- Số thứ tự nhóm:
