Chuyên đề 14. Andehit - Xeton - Axit cacboxylic
Phản ứng của axit cacboxylic với kim loại
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ sáu, 10 Tháng 7 2015 22:12
- Viết bởi Nguyễn Văn Đàm
- Axit cacboxylic phản ứng được với kim loại đứng trước H trong dãy hoạt động hóa học của kim loại tạo thành muối và giải phóng khí H2 (thường gặp là phản ứng với kim loại kiềm).
- Phản ứng tổng quát của axit cacboxylic với kim loại kiềm M:
R(COOH)x + xM → R(COOM)x + x/2H2
- Khi giải bài tập về phản ứng của axit cacboxylic tác dụng với kim loại cần lưu ý:
Phản ứng đốt cháy axit cacboxylic
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 23:47
- Viết bởi Nguyễn Văn Đàm
Cũng giống như các chất hữu cơ khác, axit cacboxylic dễ dàng tham gia vào phản ứng đốt cháy:
- Phương trình phản ứng tổng quát:
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
- Dựa vào đặc điểm của phản ứng đốt cháy có thể kết luận được loại axit tham gia phản ứng.
Thường gặp nhất là các trường hợp sau:
So sánh tính axit của axit hữu cơ
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Chủ nhật, 25 Tháng 1 2015 16:00
- Viết bởi Nguyễn Văn Đàm
1. Nguyên nhân axit cacboxylic có tính axit
Phân tử axit có nhóm cacbonyl C = O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O - H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH ↔ RCOO- + H+
(RCOOH + H2O ↔ RCOO- + H3O+)
2. So sánh tính axit của các axit hữu cơ
Phản ứng của axit cacboxylic với các muối
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Chủ nhật, 25 Tháng 1 2015 15:42
- Viết bởi Nguyễn Văn Đàm
Các axit cacboxylic có khả năng phản ứng với các muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) tạo thành sản phẩm là muối mới và axit mới. Hay gặp nhất là phản ứng của axit cacboxylic với các muối cacbonat và hiđrocacbonat.
Ví dụ:
R(COOH)x + xNaHCO3 → R(COONa)x + xH2O + xCO2
Khi giải các bài tập về phản ứng của axit cacboxylic với muối cacbonat hoặc hiđrocacbonat cần chú ý:
Phản ứng của axit cacboxylic với kiềm
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 18:53
- Viết bởi Nguyễn Văn Đàm
Trong phần tính axit của axit cacboxylic thì phản ứng của axit với kiềm là phản ứng hay gặp.
- Phương trình tổng quát của phản ứng:
R(COOH)x + xNaOH → R(COONa)x + xH2O
- Nếu axit tham gia phản ứng thuộc loại đơn chức:
RCOOH + NaOH → RCOONa + H2O
- Khi giải bài tập về phản ứng của axit cacboxylic với kiềm cần lưu ý:
Phản ứng este hóa axit cacboxylic
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 18:41
- Viết bởi Nguyễn Văn Đàm
Phản ứng este hóa với ancol là phản ứng quan trọng của axit cacboxylic.
- Phương trình phản ứng tổng quát:
R(COOH)x + R’(OH)t ↔ Ry(COO)xyR’x + xyH2O (xúc tác H2SO4, t0)
Lí thuyết về axit cacboxylic
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 16:53
- Viết bởi Nguyễn Văn Đàm
I. ĐỊNH NGHĨA
- Các định nghĩa về axit cacboxylic:
+ Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm - COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
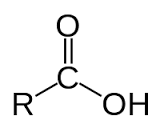
+ Axit cacboxylic là sản phẩm thu được khi thay nguyên tử H trong hiđrocacbon hoặc H2 bằng nhóm - COOH.
- Công thức tổng quát của axit:
Tổng hợp về anđehit
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 16:30
- Viết bởi Nguyễn Văn Đàm
Khi giải các bài tập về anđehit và xeton, chúng ta có thể gặp những bài cùng một lúc có liên quan đến nhiều phản ứng của anđehit như: phản ứng tráng bạc và phản ứng cộng H2; phản ứng tráng bạc và phản ứng cháy... Để giải quyết được những bài tập tổng hợp như thế đòi hỏi người làm phải nắm vững kiến thức có liên quan và kĩ năng giải bài tập liên quan đến từng phản ứng riêng lẻ.
Hochoaonline.net mời các bạn tham khảo một số bài tập dưới đây:
Điều chế anđehit, xeton
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 16:24
- Viết bởi Nguyễn Văn Đàm
Có nhiều cách khác nhau để điều chế anđehit, xeton:
I. ĐIỀU CHẾ ANĐEHIT
1. Oxi hóa ancol bậc I
R(CH2OH)x + xCuO → R(CHO)x + xCu + xH2O (t0)
Phản ứng cộng hiđro của anđehit, xeton
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 16:05
- Viết bởi Nguyễn Văn Đàm
Do trong phân tử luôn có liên kết bội (ở nhóm chức cacbonyl) nên các anđehit và xeton đều có khả năng tham gia phản ứng cộng H2. Vì phản ứng của xeton có đặc điểm hoàn toàn tương tự với phản ứng cộng H2 của anđehit nên ở đây chỉ đề cập đến phản ứng cộng H2 vào anđehit.
R(CHO)x + xH2 → R(CH2OH)x (xúc tác Ni, t0)
Bài tập về phản ứng cộng H2 của anđehit, xeton thường gắn liền với bài tập ancol tác dụng với Na.
Chú ý: