Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
Cấu tạo nguyên tử và bài toán các hạt cơ bản
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Chủ nhật, 08 Tháng 2 2015 10:17
- Viết bởi Nguyễn Văn Đàm
Nguyên tử là các hạt vô cùng nhỏ bé nhưng nó lại có cấu tạo phức tạp.
1. Cấu tạo nguyên tử
Nguyên tử gồm 2 phần:
- Vỏ nguyên tử: gồm các electron (e) chuyển động rất nhanh: me = 9,1094.10-31kg; qe = -1,602.10-19C.
- Hạt nhân nguyên tử: hầu hết đều được tạo thành từ proton và nơtron (trừ nguyên tử 1H trong hạt nhân không có nơtron).
+ Proton (p): mp = 1,6726.10-27kg; qp = 1,602.10-19C.
+ Nơtron (n): mn = 1,6748.10-27kg; qn = 0.

Đồng vị
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 09:01
- Viết bởi Nguyễn Văn Đàm
Hầu hết các nguyên tố hoá học đều là tập hợp của nhiều đồng vị. Vậy kiến thức về đồng vị có những nội dung gì và hay gặp các dạng bài tập nào về đồng vị? Bài viết này sẽ giúp các em trả lời được những câu hỏi đó.
1. Khái niệm đồng vị
- Đồng vị là hiện tượng các nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
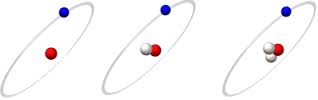
- Hầu hết các nguyên tố hoá học đều là tập hợp của nhiều đồng vị.
- Công thức tính khối lượng nguyên tử trung bình của các đồng vị:
A = (M1.x1 + M2.x2 + ...)/(x1 + x2 + ...)
Trong đó:
+ M1, M2,... Mn là số khối của các đồng vị.
+ x1, x2,... xn là số mol, % số mol; số nguyên tử; % số nguyên tử; thể tích; % thể tích của khí).
2. Các dạng bài tập cơ bản về đồng vị
Cấu hình electron nguyên tử
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 09:11
- Viết bởi Nguyễn Văn Đàm
Vỏ nguyên tử là một trong 2 bộ phận cấu thành nên nguyên tử. Vỏ nguyên tử được hình thành từ các electron. Trong vỏ nguyên tử, các electron chuyển động và phân bố như thế nào? Câu hỏi đó được giải đáp trong nội dung bài viết này:
1. Sự chuyển động của các electron trong nguyên tử
Electron chuyển động rất nhanh trong khu vực quanh hạt nhân không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
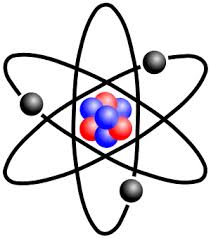
2. Lớp và phân lớp electron
- Chia e thành các lớp và các phân lớp dựa theo mức năng lượng của e.
- Từ sát hạt nhân trở ra, năng lượng của các e tăng dần.
a. Lớp e
- Lớp e gồm các e có mức năng lượng gần bằng nhau.
- Từ sát hạt nhân trở ra ta có số thứ tự các lớp e và tên của các lớp tương ứng là:
Bài toán khối lượng riêng
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 09:21
- Viết bởi Nguyễn Văn Đàm
Bài toán về khối lượng riêng của nguyên tử đã xuất hiện trong đề thi tuyển sinh những năm gần đây. Mặc dù nguyên tử có kích thước và khối lượng vô cùng nhỏ bé nhưng khối lượng riêng của nguyên tử lại có giá trị khá lớn.
- Các nguyên tử có cấu tạo rỗng (độ đặc khít a%).
- Nguyên tử được coi có dạng hình cầu nên thể tích của nguyên tử được tính theo công thức:
Cấu tạo bảng tuần hoàn các nguyên tố hóa học
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 09:42
- Viết bởi Nguyễn Văn Đàm
Trong nghiên cứu, giảng dạy và học tập môn hóa học, bảng tuần hoàn là công cụ vô cùng quan trọng và hữu ích.

1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Theo chiều tăng dần của điện tích hạt nhân.
- Cùng số lớp e xếp vào cùng một hàng (chu kì).
- Cùng số e hóa trị được xếp vào cùng một cột (nhóm).
Mối quan hệ giữa cấu hình e với vị trí của nguyên tố
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 10:00
- Viết bởi Nguyễn Văn Đàm
Giữa cấu hình electron nguyên tử và vị trí của nguyên tố trong bảng tuần hoàn có mối quan hệ qua lại với nhau. Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn và ngược lại. Cụ thể như sau:
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
- Số thứ tự chu kì = số lớp e.
- Số thứ tự nhóm:
Mối quan hệ giữa cấu hình e với vị trí của nguyên tố trong bảng tuần hoàn
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 10:01
- Viết bởi Nguyễn Văn Đàm
MỐI QUAN HỆ GIỮA CẤU HÌNH ELECTRON NGUYÊN TỬ VÀ VỊ TRÍ
NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Giữa cấu hình electron nguyên tử và vị trí của nguyên tố trong bảng tuần hoàn có mối quan hệ qua lại với nhau. Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn và ngược lại. Cụ thể như sau:
Mối quan hệ giữa cấu hình e và tính chất nguyên tố
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 10:30
- Viết bởi Nguyễn Văn Đàm
Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được một số tính chất đặc trưng của nguyên tố đó. Cụ thể là:
1. Loại nguyên tố
- Nguyên tử có 1, 2, 3 e ở lớp ngoài cùng: là nguyên tố kim loại (trừ H, He).
- Nguyên tử có 5, 6, 7 e ở lớp ngoài cùng: thường là nguyên tố phi kim.
- Nguyên tử có 8e ở lớp ngoài cùng: là nguyên tố khí hiếm (cả trường hợp He có 2e).
- Nguyên tử có 4e ở lớp ngoài cùng là phi kim nếu thuộc chu kì 2, 3 và là kim loại nếu thuộc các chu kì khác.
So sánh tính chất của các nguyên tố trong bảng tuần hoàn
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 10:48
- Viết bởi Nguyễn Văn Đàm
Một số tính chất của các nguyên tố trong bảng tuần hoàn biến đổi có quy luật theo chu kì và theo nhóm. Vì vậy dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, có thể so sánh được tính chất của các nguyên tố đó:
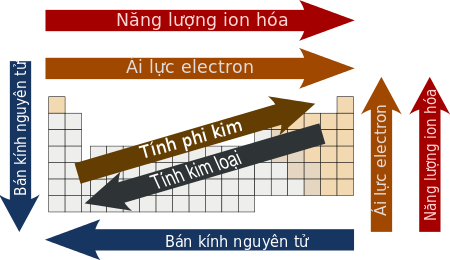
Cụ thể là:
Mối quan hệ giữa các nguyên tố trong bảng tuần hoàn
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Thứ hai, 09 Tháng 2 2015 14:18
- Viết bởi Nguyễn Văn Đàm
Vị trí của các nguyên tố trong bảng tuần hoàn có mối quan hệ với nhau.

Cụ thể là:
- Nếu 2 nguyên tố A và B ở cùng 1 chu kì và ở 2 nhóm A liên tiếp thì:
|ZA - ZB| = 1 nếu nguyên tố thuộc chu kì nhỏ
|ZA - ZB| = 11 nếu nguyên tố thuộc chu kì lớn và ở nhóm IIA và IIIA
- Nếu 2 nguyên tố thuộc cùng một nhóm A và ở 2 chu kì liên tiếp thì: