Chương 1. Sự điện li
Thuyết axit - bazơ
- Chi tiết
- Chuyên mục: Chương 1. Sự điện li
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 10:53
- Viết bởi Nguyễn Văn Đàm
I. AXIT
1. Định nghĩa
- Định nghĩa:
+ Thuyết điện li: Axit là chất khi tan trong nước phân li ra ion H+.
+ Thuyết Bronsted: Axit là những chất có khả năng cho proton (ion H+).
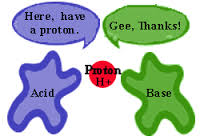
Axit và bazơ theo quan điểm của Bronsted
- Axit gồm:
+ Các axit vô cơ, hữu cơ: HCl, H2SO4, CH3COOH, (COOH)2 …
+ Các kim loại ở dạng hiđrat hóa (trừ các ion Na+, K+, Ba2+ và Ca2+): Al(H2O)33+, Cu(H2O)22+…
+ Các ion: H+, NH4+, H3O+, RNH3+, HSO4- ...
2. So sánh tính axit của các axit
a. So sánh định tính
- Nguyên tắc chung: Nguyên tử H càng linh động thì tính axit càng mạnh.
- Đối với các axit có oxi của cùng một nguyên tố: càng nhiều O tính axit càng mạnh.
HClO < HClO2 < HClO3 < HClO4
- Đối với axit của các nguyên tố trong cùng chu kì: nguyên tố trung tâm có tính phi kim càng mạnh thì tính axit của axit càng mạnh (các nguyên tố đều ở mức hóa trị cao nhất).
H3PO4 < H2SO4 < HClO4
- Đối với axit của các nguyên tố trong cùng một nhóm A thì:
+ Axit không có oxi: tính axit tăng dần từ trên xuống dưới:
HF < HCl < HBr < HI (do bán kính ion X- tăng)
+ Axit có O: tính axit giảm dần từ trên xuống dưới:
HClO4 > HBrO4 > HIO4 (do độ âm điện của X giảm dần)
- Với các axit hữu cơ RCOOH: (nguyên tử H được coi không có khả năng hút hoặc đẩy e)
+ Nếu gốc R no (đẩy e) làm giảm tính axit. Gốc R no càng nhiều nguyên tử C thì khả năng đẩy e càng mạnh: HCOOH > CH3COOH > CH3CH2COOH > CH3CH2CH2COOH > n-C4H9COOH.
+ Nếu gốc R hút e (không no, thơm hoặc có halogen...) sẽ làm tăng tính axit.
* Xét với gốc R có chứa nguyên tử halogen:
+ Halogen có độ âm điện càng lớn thì tính axit càng mạnh:
CH2FCOOH > CH2ClCOOH > CH2BrCOOH > CH2ICOOH > CH3COOH
+ Gốc R có chứa càng nhiều nguyên tử halogen thì tính axit càng mạnh:
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH > CH3COOH
+ Nguyên tử halogen càng nằm gần nhóm COOH thì tính axit càng mạnh:
CH3CH2CHClCOOH > CH3CHClCH2COOH > CH2ClCH2CH2COOH > CH3CH2CH2COOH
- Với một cặp axit/bazơ liên hợp: tính axit càng mạnh thì bazơ liên hợp của nó càng yếu và ngược lại.
- Với một phản ứng: axit mạnh đẩy được axit yếu khỏi dung dịch muối (trường hợp trừ một số đặc biệt).
b. So sánh định lượng
- Với axit HX trong nước có cân bằng:
HX ↔ H+ + X- ta có hằng số phân ly axit: KA
- KA chỉ phụ thuộc nhiệt độ, bản chất của axit. Giá trị của KA càng lớn tính axit của axit càng mạnh.
II. BAZƠ
1. Định nghĩa
- Định nghĩa:
+ Thuyết điện li: Bazơ là chất khi tan trong nước phân li ra ion OH-.
+ Thuyết Bronsted: Bazơ là những chất có khả năng nhận proton (nhận H+).
- Bazơ gồm:
+ Oxit và hiđroxit của kim loại (trừ các oxit và hiđroxit lưỡng tính: Al2O3, Al(OH)3, ZnO, Zn(OH)2...).
+ Các anion gốc axit không mạnh không còn H có thể tách thành ion H+ (CO32-, CH3COO-, S2-, SO32-, C6H5O-...).
+ NH3 và các amin: C6H5NH2, CH3NH2...
2. So sánh tính bazơ của các bazơ
a. So sánh định tính
- Nguyên tắc chung: khả năng nhận H+ càng lớn thì tính bazơ càng mạnh.
- Với oxit, hiđroxit của các kim loại trong cùng một chu kì: tính bazơ giảm dần từ trái sang phải.
NaOH > Mg(OH)2 > Al(OH)3 và Na2O > MgO > Al2O3
- Với các nguyên tố thuộc cùng một nhóm A: tính bazơ của oxit, hidroxit tăng dần từ trên xuống dưới.
LiOH < NaOH < KOH < RbOH
- Với amin và amoniac: Gốc R đẩy e làm tăng tính bazơ ngược lại gốc R hút e làm giảm tính bazơ.
(C6H5)3N < (C6H5)2NH < C6H5NH2 < NH3 < CH3NH2 < (CH3)2NH
- Trong một phản ứng bazơ mạnh đẩy bazơ yếu khỏi muối.
- Axit càng mạnh thì bazơ liên hợp càng yếu và ngược lại.
b. So sánh định lượng
- Với bazơ B trong nước có phương trình phân ly là:
B + H2O ↔ HB + OH- ta có hằng số phân ly bazơ KB.
- KB chỉ phụ thuộc bản chất bazơ và nhiệt độ. Giá trị KB càng lớn thì bazơ càng mạnh.
III. CHẤT LƯỠNG TÍNH
- Định nghĩa:
+ Thuyết điện li: Chất lưỡng tính là chất trong nước có thể phân li theo cả kiểu axit và kiểu bazơ.
+ Thuyết Bronsted: Chất lưỡng tính là những chất vừa có khả năng cho proton H+, vừa có khả năng nhận proton H+.
- Chất lưỡng tính gồm:
+ H2O, oxit và hiđroxit lưỡng tính (ZnO, Zn(OH)2, Al2O3, Al(OH)3, Cr2O3, Cr(OH)3 ...)
+ Aminoaxit, muối amoni của axit hữu cơ (R(COOH)x(NH2)y, RCOONH4...)
+ Anion gốc axit không mạnh vẫn còn khả năng tách H+ (HCO3-, HS-, HSO3‑, H2PO4-, HPO42-...)
IV. CHẤT TRUNG TÍNH
- Là những chất không có khả năng cho và nhận proton (H+).
- Chất trung tính gồm:
+ Cation của bazơ mạnh: K+, Na+, Ca2+, Ba2+.
+ Anion của axit mạnh không còn H: Cl-, SO42-, Br-, I-, NO3-...
V. SỰ KẾT HỢP GIỮA CÁC ION
Nếu ta kí hiệu trung tính (1), axit (A), bazơ (B) và lưỡng tính (0) thì ta có bảng nhân:
|
Cation |
Anion |
Phân tử |
|
A |
A |
A |
|
A |
B |
0 |
|
A |
0 |
0 |
|
A |
1 |
A |
|
1 |
1 |
1 |
|
1 |
0 |
0 |
|
1 |
A |
A |
|
1 |
B |
B |
Mời các bạn tham gia giải các bài tập sau cùng hochoaonline.net:
