Chương 6. Nhóm VIA. Oxy - Lưu Huỳnh
Hiđro sulfua và axit sulfuhidric
- Chi tiết
- Chuyên mục: Chương 6. Nhóm VIA. Oxy - Lưu Huỳnh
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 22:10
- Viết bởi Nguyễn Văn Đàm
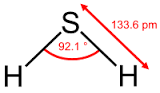
1. Tính chất vật lí
- Hiđro sunfua (H2S) là chất khí không màu, mùi trứng thối, độc, ít tan trong nước.
- Khi tan trong nước tạo thành dung dịch axit yếu sunfuhiđric.
2. Tính chất hóa học
- Dung dịch H2S có tính axit yếu (yếu hơn axit cacbonic) nên không làm quỳ tím đổi màu.
- Tác dụng với kim loại mạnh:
2Na + H2S → Na2S + H2
- Tác dụng với oxit kim loại (ít gặp).
- Tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối hiđrosunfua và sunfua)
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
- Tác dụng với dung dịch muối tạo muối không tan trong axit:
H2S + CuSO4 → CuS + H2SO4
- H2S có tính khử mạnh (vì S trong H2S có mức oxi hóa thấp nhất - 2)
+ Tác dụng với oxi:
2H2S + O2 → 2H2O + 2S (thiếu oxi, phản ứng xảy ra ở nhiệt độ thấp)
2H2S + 3O2 → 2H2O + 2SO2 (dư oxi, phản ứng xảy ra ở nhiệt độ cao)
+ Tác dụng với các chất oxi hóa khác:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
H2S + 8HNO3 đặc → H2SO4 + 8NO2 + 4H2O
H2S + H2SO4 đặc → S + SO2 + 2H2O
3. Điều chế
Dùng axit mạnh đẩy H2S ra khỏi muối (trừ muối không tan trong axit):
FeS + 2HCl → FeCl2 + H2S
4. Nhận biết
- Mùi trứng thối
- Làm đen dung dịch Pb(NO3)2 và Cu(NO3)2
Pb(NO3)2 + H2S → PbS + 2HNO3
Cu(NO3)2 + H2S → CuS + 2HNO3
- Làm mất màu dung dịch Brom, dung dịch KMnO4…
Hochoaonline.net giới thiệu các bài tập về H2S đến các bạn:
