Chương 6. Nhóm VIA. Oxy - Lưu Huỳnh
Oxi và Ozon
- Chi tiết
- Chuyên mục: Chương 6. Nhóm VIA. Oxy - Lưu Huỳnh
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 10:36
- Viết bởi Nguyễn Văn Đàm
I. OXI

1. Tính chất vật lí
Là chất khí không màu, không mùi, nặng hơn không khí. Ít tan trong nước.
2. Tính chất hóa học
Là một phi kim hoạt động (do có độ âm điện lớn 3,44 chỉ kém F).
a. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Ag, Au và Pt) → oxit. Các phản ứng thường xảy ra ở nhiệt độ cao.
2Mg + O2 → 2MgO
3Fe + 2O2 → Fe3O4 (thường tạo hỗn hợp 4 chất rắn)
b. Tác dụng với phi kim
- Oxi phản ứng với hầu hết các phi kim (trừ halogen) tạo thành oxit axit hoặc oxit không tạo muối.
- Các phản ứng thường xảy ra ở nhiệt độ cao.
S + O2 → SO2
C + O2 → CO2
2C + O2 → 2CO
N2 + O2 → 2NO (30000C, có tia lửa điện)
c. Tác dụng với hợp chất có tính khử
2CO + O2 → 2CO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3. Ứng dụng
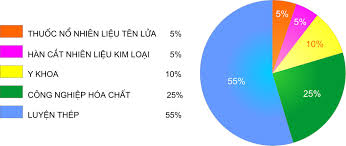
- Có vai trò quyết định đối với sự sống của người và động vật. Oxi không thể thiếu đối với quá trình hô hấp.
- Oxi cũng được dùng nhiều trong công nghiệp hóa chất, luyện thép, y khoa, hàn cắt kim loại...
4. Điều chế
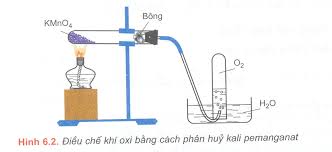
a. Trong phòng thí nghiệm: nhiệt phân các hợp chất giàu oxi.
2KClO3 → 2KCl + 3O2 (MnO2)
2KMnO4 → K2MnO4 + MnO2 + O2
2KNO3 → 2KNO2 + O2
2H2O2 → 2H2O + O2 (MnO2)
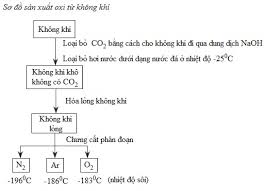
b. Trong công nghiệp
- Điện phân nước:
2H2O → 2H2 + O2 (H2SO4, NaOH, NaCl ...)
- Chưng cất phân đoạn không khí lỏng.
II. OZON
1. Tính chất vật lí
Là chất khí, mùi đặc trưng, màu xanh nhạt. Khi hóa lỏng có màu xanh đậm. Tan trong nước nhiều hơn oxi.
2. Tính chất hóa học
- Có tính oxi hóa mạnh hơn Oxi:
O3 + 2KI + H2O → 2KOH + I2 + O2
2Ag + O3 → Ag2O + O2 (phản ứng xảy ra ngay ở nhiệt độ thường).
3. Ứng dụng
- Lượng nhỏ ozon trong không khí có tác dụng làm cho không khí trong lành.
- Trong thương mại dùng để tẩy trắng các loại tinh bột, dầu ăn và nhiều chất khác.
- Trong đời sống được dùng để khử trùng nước ăn, khử mùi, bảo quản hoa quả.
- Trong y khoa được dùng chữa sâu răng.
4. Điều chế
Phóng điện qua bình đựng khí oxi.
3O2 ↔ 2O3 (tia lửa điện)
Hochoaonline.net giới thiệu đến các bạn các bài tập tham khảo về oxi, ozon:
