Chuyên đề 13. Dẫn xuất halogen, ancol, phenol
Phản ứng của ancol với axit
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ sáu, 10 Tháng 7 2015 18:05
- Viết bởi Nguyễn Văn Đàm
Ancol tác dụng được với cả axit hữu cơ và axit vô cơ. Thường gặp và cũng quan trọng nhất là phản ứng của ancol với axit hữu cơ. Phản ứng này được gọi là phản ứng este hóa.
1. Với axit vô cơ HX
CnH2n+2-2k-z(OH)z + (z + k) HX → CnH2n + 2 - zXz + k
→ số nguyên tử X bằng tổng số nhóm OH và số liên kết pi.
Điều chế ancol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ sáu, 10 Tháng 7 2015 17:53
- Viết bởi Nguyễn Văn Đàm
Có nhiều phương pháp khác nhau để điều chế ancol:
1. Thủy phân dẫn xuất halogen
CnH2n+2-2k-xXx + xMOH → CnH2n+2-2k-x(OH)x + xMX
2. Cộng nước vào anken tạo ancol no, đơn chức, mạch hở
CnH2n + H2O → CnH2n+1OH (H+)
Phản ứng tuân theo quy tắc cộng Maccopnhicop nên nếu anken đối xứng thì phản ứng chỉ tạo thành 1 ancol.
Bài tập tính toán của phenol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 11:15
- Viết bởi Nguyễn Văn Đàm
Bài tập tính toán của phenol tương đối đơn giản và ít gặp trong đề. Các bài tập đều xoay quanh các phản ứng của sau:
1. Tác dụng với Na
C6H5OH + Na → C6H5ONa + 1/2H2
2. Tác dụng với dung dịch kiềm
C6H5OH + NaOH → C6H5ONa + H2O
3. Phản ứng với dung dịch brom
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
Chú ý:
Lí thuyết về phenol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 11:00
- Viết bởi Nguyễn Văn Đàm
I. ĐỊNH NGHĨA
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C của vòng benzen.
Chú ý: Phân biệt giữa phenol và ancol thơm (có vòng benzen nhưng nhóm OH liên kết với C của nhánh).
- Thường chỉ xét phenol đơn giản nhất là C6H5OH. Ngoài ra còn có crezol CH3–C6H4–OH, HO-C6H4-OH (o-catechol, m-rezoxinol, p-hidroquinol).
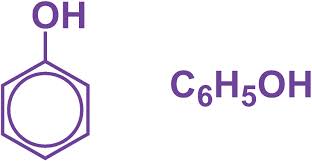
Công thức cấu tạo và công thức phân tử của phenol
Phản ứng tách nước của ancol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 10:40
- Viết bởi Nguyễn Văn Đàm
Phản ứng tách nước (đề hiđrat hóa) của ancol có 2 kiểu như sau:
1. Tách nước từ 1 phân tử ancol tạo hiđrocacbon không no
- Điều kiện: xúc tác H2SO4 đặc, đun nóng (> 1700c).
- Cách thức phản ứng: Nhóm -OH của ancol tách ra cùng với nguyên tử H của C liền cạnh C mang nhóm OH tạo ra liên kết pi giữa 2 nguyên tử C đó.
- Hướng tạo sản phẩm chính: Nhóm -OH ưu tiên tách cùng nguyên tử H của C bậc cao hơn.
- Điều kiện của ancol tham gia phản ứng: Ancol có Hα (C liền cạnh C mang nhóm OH còn H)
Chú ý:
Phản ứng của ancol với Na
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 10:09
- Viết bởi Nguyễn Văn Đàm
Phản ứng với kim loại kiềm là phản ứng đặc trưng của ancol nói riêng và các hợp chất hữu cơ có chứa nguyên tử H linh động nói chung:
R(OH)z + zNa → R(ONa)z + z/2H2
Muối R(ONa)z (Natri ancolat) rất dễ bị thủy phân trong nước:
R(ONa)z + zH2O → R(OH)z + zNaOH
Chú ý:
Phản ứng oxi hóa không hoàn toàn ancol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 09:49
- Viết bởi Nguyễn Văn Đàm
Bài tập về phản ứng oxi hóa không hoàn toàn cũng là một dạng bài tập thường gặp với ancol. Phản ứng oxi hóa không hoàn toàn của ancol xảy ra khi cho ancol tác dụng với CuO đun nóng hoặc với O2 có xúc tác là Cu, đun nóng (thường gặp phản ứng của ancol với CuO, đun nóng). Tùy theo bậc của ancol mà tạo ra các sản phẩm khác nhau:
- Ancol bậc I + CuO tạo anđehit:
RCH2OH + CuO → RCHO + Cu + H2O
- Ancol bậc II + CuO tạo xeton:
RCHOHR’ + CuO → RCOR’ + Cu + H2O
- Ancol bậc III không bị oxi hóa bằng CuO.
Chú ý:
Phản ứng với Đồng (II) hiđroxit
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 09:38
- Viết bởi Nguyễn Văn Đàm
Ngoài các tính chất chung của ancol, những ancol đa chức có nhiều nhóm OH liền kề còn có phản ứng đặc trưng với Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam:
2R(OH)2 + Cu(OH)2 → [R(OH)O]2Cu + 2H2O
Phản ứng cháy của ancol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 09:28
- Viết bởi Nguyễn Văn Đàm
Ancol cũng như các chất hữu cơ rất dễ cháy tạo ra sản phẩm là CO2 và H2O. Phản ứng cháy của ancol có phương trình chung dạng:
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Chú ý:
Lý thuyết về ancol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 09:14
- Viết bởi Nguyễn Văn Đàm
I. ĐỊNH NGHĨA
- Ancol là những hợp chất hữu cơ trong phân tử có chứa nhóm -OH liên kết với nguyên tử C no (C sp3) của gốc hiđrocacbon.
- Ancol là sản phẩm thu được khi thay thế nguyên tử H liên kết với C sp3 trong hiđrocacbon bằng nhóm -OH.
- Công thức tổng quát của ancol: