Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
pH và môi trường của dung dịch
- Chi tiết
- Chuyên mục: Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
- Được viết ngày Thứ năm, 05 Tháng 3 2015 18:02
- Viết bởi Nguyễn Văn Đàm
1. Tích số ion của nước
- Nước là chất điện li rất yếu (ở nhiệt độ thường, cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li thành ion).
- Tích số: KH2O = [H+].[OH-] = 1,0.10-7 được gọi là tích số ion của nước. Giá trị này được tính với nước ở 250c. Một cách gần đúng, có thể coi giá trị tích số ion của nước là hằng số cả trong dung dịch loãng của các chất khác nhau.
2. Khái niệm về pH


Giấy chỉ thị màu axit - bazơ và máy đo pH để xác định pH của dung dịch
- Nếu dung dịch có [H+] = 1,0.10-a → pH = a.
- Biểu thức toán học tính pH: pH = -lg[H+].
- Tương tự có khái niệm pOH, pK. Ta có mối quan hệ trong dung dịch nước: pH + pOH = 14.
3. Các loại môi trường
|
Môi trường |
[H+] |
pH |
Là dung dịch của |
|
Axit |
> 10-7 |
< 7 |
Axit hoặc chất lưỡng tính mà tính axit mạnh hơn tính bazơ |
|
Bazơ |
< 10-7 |
> 7 |
Bazơ hoặc chất lưỡng tính mà tính bazơ mạnh hơn tính axit |
|
Trung tính |
= 10-7 |
= 7 |
Chất trung tính hoặc chất lưỡng tính mà tính axit và bazơ tương đương |
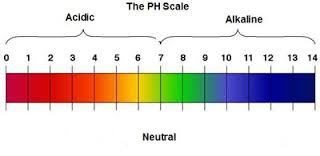
pH và môi trường của dung dịch
Hochoaonline.net mời các bạn tham khảo các bài tập sau: